ТИАНСек адаптер са једним индексом (Иллумина)
Карактеристике
■ Погодно: СетА и СетБ испоручују 24 појединачна индекса, који се могу слободно бирати према захтевима.
■ Једноставан за употребу: Комплет је опремљен адаптером за разблаживање адаптера, који има јаку стабилност и може се директно користити за разблаживање раствора адаптера.
■ Контрола квалитета: Строга контрола квалитета и функционална провера између серија обезбеђују тачност редоследа индекса.
Апликације
1. Овај производ се користи за изградњу ДНК и РНК библиотека за Иллумина високопропусну платформу за секвенцирање у примени секвенцирања следеће генерације (НГС).
2. Специфичне примене производа укључују секвенцирање целог егзона, циљано секвенцирање, РНА-Сек, ЦхИП-Сек, усмерено секвенцирање и секвенцирање целог генома.
3. Треба напоменути да овај производ није погодан за секвенцирање везано за метилацију.
Информације о низу адаптера
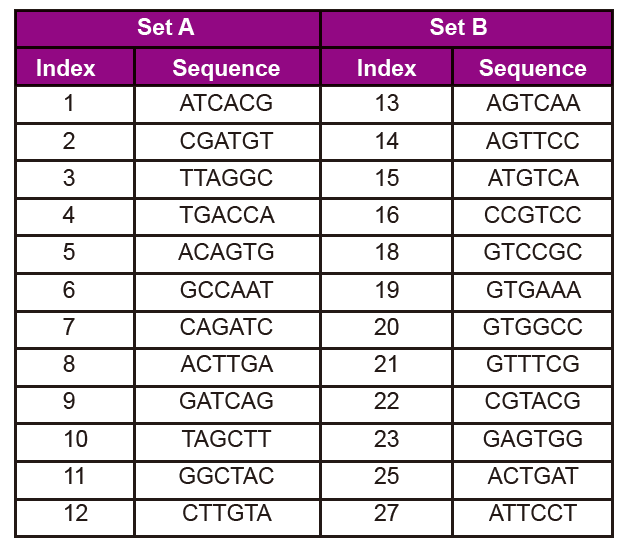
Низ адаптера укључује следеће информације:
1. Универзална секвенца
5'-ААТГАТАЦГГЦГАЦЦАЦЦГАГАТЦТАЦАЦТЦТТТЦЦЦТ
АЦАЦГАЦГЦТЦТТЦЦГАТЦТ-3 '
2. Индекс укључујући низ
5'-ГАТЦГГААГАГЦАЦАЦГТЦТГААЦТЦЦАГТЦАЦ [индекс1-27] АТЦТЦГТАТГЦЦГТЦТТЦТГЦТТГ-3 '
3. Број индекса и редослед
Сви производи се могу прилагодити за ОДМ/ОЕМ. За детаље,кликните Прилагођена услуга (ОДМ/ОЕМ)
Тренутно се високопропусна технологија секвенцирања углавном заснива на технологији секвенцирања следеће генерације. Како је дужина читања следеће генерације технологије секвенцирања ограничена, морамо разбити секвенцу целе дужине у мале библиотеке фрагмената до секвенце. У складу са потребама различитих експеримената секвенцирања, обично бирамо једноструко или двоструко секвенцирање. Тренутно се фрагменти ДНК библиотеке за секвенцирање следеће генерације генерално дистрибуирају у распону од 200-800 бп.

а) ДНК је лошег квалитета и садржи инхибиторе. Користите висококвалитетне узорке ДНК како бисте избегли инхибицију ензимске активности.
б) Количина узорка ДНК је недовољна када се користи метода без ПЦР за конструисање ДНК библиотеке. Када унос фрагментиране ДНК пређе 50 нг, ток рада без ПЦР-а може се селективно спровести током процеса изградње библиотеке. Ако је број копија библиотеке пренизак да би се могао директно секвенцирати, ДНК библиотека се може амплификовати ПЦР -ом након лигације адаптера.
ц) Контаминација РНК доводи до нетачне почетне квантификације ДНК Контаминација РНА може постојати у процесу пречишћавања геномске ДНК, што може довести до нетачне квантификације ДНК и недовољног учитавања ДНК током изградње библиотеке. РНК се може уклонити третирањем са РНазом.
А-1
а) Појављују се мали фрагменти (60 бп-120 бп) Мали фрагменти су обично фрагменти адаптера или димери формирани помоћу адаптера. Пречишћавање помоћу магнетних перлица Агенцоурт АМПуре КСП може ефикасно уклонити ове фрагменте адаптера и осигурати квалитет секвенцирања.
б) Велики фрагменти се појављују у библиотеци након ПЦР амплификације. Величина фрагмента ДНК библиотеке ће се повећати за 120 бп након што се адаптер повеже. Ако се фрагмент ДНК повећа за више од 120 бп након лигације адаптера, то може бити узроковано абнормалном амплификацијом фрагмента прекомерном амплификацијом ПЦР -а. Смањење броја циклуса ПЦР -а може спречити ситуацију.
ц) Ненормална величина ДНК фрагмената библиотеке након лигације адаптера Дужина адаптера у овом комплету је 60 бп. Када се два краја фрагмента повежу са адаптерима, дужина ће се повећати само за 120 бп. Када користите адаптер који није предвиђен овим комплетом, обратите се добављачу да вам пружи релевантне информације, као што је дужина адаптера. Уверите се да ток рада и рад експеримента следе кораке описане у приручнику.
д) Абнормална величина фрагмента ДНК пре лигације адаптера Разлог за овај проблем може бити узрокован погрешним реакционим условима током фрагментације ДНК. За различит унос ДНК треба користити различита времена реакције. Ако је унос ДНК већи од 10 нг, препоручујемо да се за почетак оптимизације изабере време реакције од 12 минута, а величина фрагмента који се у овом тренутку производи углавном је у распону од 300-500 бп. Корисници могу повећати или смањити дужину фрагмената ДНК за 2-4 минуте у складу са сопственим захтевима како би оптимизовали фрагменте ДНК потребне величине.
А-2
а) Време фрагментације није оптимизовано Ако је фрагментирана ДНК премала или превелика, молимо вас да погледате Смернице за одабир времена фрагментације дате у упутству за одређивање времена реакције и користите ову временску тачку као контролу, додатно поставите реакциони систем за продужење или скраћивање 3 минута ради прецизнијег подешавања времена фрагментације.
А-3
Абнормална дистрибуција ДНК по величини након третмана фрагментације
а) Нетачна метода одмрзавања реагенса за фрагментацију или реагенс није потпуно измешан након одмрзавања. Одмрзните 5 × реагенс мешавине фрагментације на леду. Након одмрзавања, равномерно мешајте реагенс лаганим преласком по дну епрувете. Не вртложите реагенс!
б) Улазни узорак ДНК садржи ЕДТА или друге загађиваче. Осиромашење јона соли и хелатних агенаса у кораку пречишћавања ДНК је посебно важно за успех експеримента. Ако се ДНК раствори у 1 × ТЕ, користите методу наведену у упутству за извођење фрагментације. Ако је концентрација ЕДТА у раствору неизвесна, препоручује се прочишћавање ДНК и раствор у дејонизованој води ради касније реакције.
ц) Нетачна почетна квантификација ДНК Величина фрагментиране ДНК је уско повезана са количином унете ДНК. Пре третмана фрагментације, тачна квантификација ДНК користећи Кубит, Пицогреен и друге методе је неопходна за одређивање тачне количине ДНК у реакционом систему.
д) Припрема реакционог система не следи упутства. Припрема фрагментираног реакционог система мора се спровести на леду строго у складу са упутствима. Да би се обезбедио најбољи ефекат, све реакционе компоненте треба ставити на лед и припремити реакциони систем након потпуног хлађења. Након што је припрема завршена, молимо вас да прелистате или пипетом добро промешате. Не вртите!
1. Неправилна метода мешања (вртлог, снажне осцилације итд.) Изазваће абнормалну дистрибуцију фрагмената библиотеке (као што је приказано на следећој слици), утичући на квалитет библиотеке. Стога, приликом припреме реакционог раствора за фрагментацијску мешавину, пажљиво пипетом нагоре и надоле мешајте, или врхом прста лагано листајте и мешајте. Пазите да се не помешате са вртлогом.

2. ДНК високе чистоће мора се користити за изградњу библиотеке
■ Добар интегритет ДНК: Трака електрофорезе је већа од 30 кб, без праћења
■ ОД260/230:> 1.5
■ ОД260/280: 1,7-1,9
3. Количина унете ДНК мора бити тачна Предлаже се употреба Кубит и ПицоГреен метода за квантификацију ДНК, уместо Нанодропа.
4. Мора се одредити садржај ЕДТА у раствору ДНК ЕДТА има велики утицај на реакцију фрагментације. Ако је садржај ЕДТА висок, пре следећег теста потребно је извршити пречишћавање ДНК.
5. Реакциони раствор за фрагментацију мора се припремити на леду. Процес фрагментације је осетљив на температуру и време реакције (нарочито након додавања појачивача). Да бисте осигурали тачност времена реакције, припремите реакциони систем на леду.
6. Време реакције фрагментације мора бити тачно Време реакције у кораку фрагментације ће директно утицати на величину продуката фрагмената, утичући тако на расподелу величине ДНК фрагмената у библиотеци.
1. Која врста узорка је применљива на овај комплет?
Примјењиви тип узорка овог комплета може бити укупна РНК или пречишћена мРНК са добрим интегритетом РНК. Ако се за изградњу библиотеке користи укупна РНК, препоручује се употреба комплета за исцрпљивање рРНА (Цат#4992363/4992364/4992391) за прво уклањање рРНА.
2. Могу ли се узорци ФФПЕ -а користити за израду библиотеке са овим комплетом?
МРНА у узорцима ФФПЕ -а ће бити деградирана у одређеној мери, уз релативно лош интегритет. Када се овај комплет користи за изградњу библиотеке, препоручује се оптимизација времена фрагментације (скраћивање времена фрагментације или неизвођење фрагментације).
3. Користећи корак за одабир величине који је наведен у приручнику за производ, шта може узроковати да уметнути сегмент изгледа благо одступање?
Избор величине ће се вршити у складу са кораком одабира величине у овом упутству за употребу. Ако постоји одступање, разлог би могао бити тај што магнетне куглице нису избалансиране на собну температуру или нису потпуно измешане, пипета није тачна или је течност остала у врху. За експеримент се препоручује употреба врхова са ниском адсорпцијом.
4. Избор адаптера у изградњи библиотека
Комплет за конструкцију библиотеке не садржи адаптерски реагенс, па се препоручује да се овај комплет користи заједно са ТИАНСек једно-индексним адаптером (Иллумина) (4992641/4992642/4992378).
5. КК библиотеке
Квантитативно откривање библиотеке: Кубит и кПЦР се користе за одређивање масене и моларне концентрације библиотеке. Рад је строго у складу са упутством за употребу. Концентрација библиотеке ће генерално задовољити захтеве НГС секвенцирања. Откривање распона дистрибуције библиотека: Коришћењем Агилент 2100 Биоанализер -а за откривање опсега дистрибуције библиотека.
6. Избор броја циклуса појачања
Према упутствима, број ПЦР циклуса је 6-12, а број потребних ПЦР циклуса треба изабрати у складу са улазом узорка. У библиотекама са високим приносом, прекомерно појачавање се обично јавља у различитим степенима, што се манифестује нешто већим врхом након врха циљног опсега у детекцији биоанализатора Агилент 2100, или је детектована концентрација Кубита нижа од оне у кПЦР-у. Благо појачање је нормална појава која не утиче на секвенцирање библиотеке и каснију анализу података.
7. Шиљци се појављују у профилу детекције биоанализатора Агилент 2100
Појава шиљака у детекцији биоанализатора Агилент 2100 је последица неуједначене фрагментације узорака, где ће бити више фрагмената одређене величине, а то ће постати очигледније након обогаћивања ПЦР -а. У овом случају, предлаже се да се не изврши одабир величине, односно да се подели услов фрагментације на 94 ° Ц током 15 минута инкубације, где је расподела фрагмената мала и концентрисана, а хомогеност се може побољшати.
Категорије производа
ЗАШТО ИЗАБРАТИ НАС
Наша фабрика од свог оснивања развија производе прве класе поштујући принцип
прво квалитета. Наши производи стекли су одличну репутацију у индустрији и драгоцено поверење међу новим и старим купцима.








